Energi selalu berkaitan
dengan usaha. Telah Anda ketahui bahwa usaha merupakan hasil perkalian gaya
dengan perpindahan (W = F × s). Pada Gambar di bawah memperlihatkan penampang
air silinder yang didalamnya terdapat gas piston (pengisap). Piston ini dapat
bergerak bebas naik turun. Jika luas piston A
dan tekanan gas P, maka gas akan
mendorong piston dengan gaya F = P × A. Oleh karena itu, usaha yang dilakukan
gas adalah W = F × Δs. Jika F = P × A, maka W = P × A × Δs.
Dan jika Δs = ΔV/A, maka
persamaannya menjadi seperti berkut.
W
= P × ΔV
atau W = P (V2 – V1)
Keterangan:
W : usaha (J)
P : tekanan tetap (N/m2)
V1: volume
awal (m3)
V2: volume
akhir (m3)
Gas dalam ruang
tertutup dapat mengalami beberapa proses yaitu proses isobarik, proses
isokorik, proses isotermis, dan proses adiabatik.
a. Proses Isobarik
Proses yang berlangsung
pada tekanan tetap dinamakan proses
isobarik. Bila volume gas bertambah, berarti gas melakukan usaha atau usaha gas
positif (proses ekspansi). Jika volume gas berkurang, berarti pada gas
dilakukan usaha atau usaha gas negatif (proses kompresi). Usaha yang dilakukan
oleh gas pada proses isobarik dapat dinyatakan sebagai berikut.
W
= P × ΔV
atau W = P (V2 – V1)
Usaha yang dilakukan
gas terhadap lingkungannya atau kebalikannya sama dengan luas daerah bawah
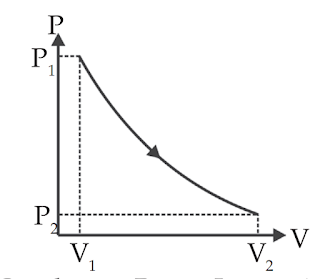
grafik tekanan terhadap volume (grafik P – V). Perhatikan Gambar berikut
b. Proses Isokorik
Proses isokorik adalah proses yang dialami oleh gas di mana
gas tidak mengalami perubahan volume atau volume tetap (ΔV = 0). Oleh karena
itu, usaha yang dilakukan gas pada proses isokorik adalah nol (W = P × 0 = 0).
Perhatikan Gambar berikut!
c. Proses Isotermis
Proses isotermas adalah
proses yang dialami gas pada suhu tetap. Usaha yang dilakukan gas pada proses
ini tidak dapat dihitung dengan persamaan W = P × ΔV. Hal ini dikarenakan
tekanannya tidak konstan. Namun, dapat diselesaikan dengan melakukan pengintegralan
d. Proses Adiabatik
Pada proses isobarik,
isotermis, dan isokorik dipengaruhi oleh lingkungan, yaitu menerima atau
melepaskan kalor. Proses adiabatik merupakan proses yang tidak ada kalor yang
masuk atau keluar dari sistem (gas) ke lingkungan (ΔQ = 0).
Hal ini dapat terjadi terdapat
sekat yang tidak menghantarkan kalor atau prosesnya berlangsung cepat. Pada
proses adiabatik berlaku rumus Poison.
PVγ
= Konstan atau P1V1γ = P2V2γ
Dengan γ merupakan perbandingan
kalor jenis gas pada tekanan tetap (Cp) dan kalor jenis gas pada volum tetap
(CV). Selanjutnya perbandingan ini dinamakan tetapan Laplace
γ
= Cp/Cv
Untuk gas ideal (P = nRT/V),
persamaan adiabatik di atas dapat ditulis dalam bentuk
P1V1γ
= P2V2γ
(nRT1)
V1γ/V1 = (nRT) V2γ /V2
T1V1γ-1
= T2V2γ-1
Adapun usaha pada
proses adiabatik dapat dicari dengan cara sebagai berikut.
Proses isobarik, proses isokorik, proses isotermis, dan proses adiabatik, Proses Termodinamika, materi dan soal Proses Termodinamika, soal dan pembahasan Proses Termodinamika, pengertian dan jenis termodinamika, janis termodinamika, penjelasan dan pengertian adiabatik, penjelasan dan pengertian isokorik, penjelasan dan pengertian isotermis, penjelasan dan pengertian isotermal, penjelasan dan pengertian isobarik,pengertian proses termodinamika, contoh soal proses termodinamika, hukum termodinamika, termodinamika doc, persamaan termodinamika, jenis termodinamika, rumus proses adiabatik, proses isobarik, rumus proses isobarik, rumus proses isotermis, rumus proses isokorik, Fisika SMA, Fisika SMP, Fisika Kelas VII, Fisika kelas VIII, Fisika Kelas IX, Fisika Kelas X, Fisika Kelas XI, Fisika Kelas XII, materi Fisika Kelas VII, materi Fisika Kelas VIII, materi Fisika Kelas IX, materi Fisika Kelas X, materi Fisika Kelas XI, materi Fisika Kelas XIII, materi dan latihan soal UN fisika SMA, materi dan latihan soal fisika SMP, materi dan latihan soal UAS fisika SMP, materi dan latihan soal fiika SMA













0 komentar:
Post a Comment