Usaha
Luar
Sistem gas melakukan
usaha luar apabila volume sistem bertambah. Dengan bertambahnya volume ini,
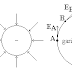
sistem melakukan usaha untuk melawan tekanan udara di luar sistem. Perhatikan Gambar
berikut ini!
Sistem gas mulamula
berada dalam kondisi P1, V1, dan T1 berada
dalam ruang yang salah satu sisinya dibatasi torak. Pada kasus ini dinding
berupa dinding diatermal. Ketika sistem menyerap kalor secara isobarik, maka
akan terjadi perubahan volume sistem menjadi V2 dimana V2
> V1. Usaha luar yang dilakukan oleh sistem gas dapat dijabarkan
sebagai berikut.
W
= F s karena F = p A maka
W
= p A s
W
= pA (h2 – h1)
W
= p (Ah2 – Ah1)
W=
p (V2 – V1)
W
= pΔV
Keterangan:
W : usaha luar
P : tekanan sistem
ΔV : perubahan volume
Contoh
Soal
Suatu sistem gas berada
dalam ruang yang fleksibel. Pada awalnya gas berada pada kondisi P1
= 1,5 × 105 N/m² , T1 = 27º C, dan V1 = 12
liter. Ketika gas menyerap kalor dari lingkungan secara isobarik suhunya berubah
menjadi 127º C. Hitunglah volume gas sekarang dan besar usaha luar yang
dilakukan oleh gas!
Penyelesaian
Diketahui : P1=
1,5 × 105 N/m2
T1= 27 + 273 = 300 K
V1= 12 liter = 1,2 × 10-2
m3
T2= 127 + 273 = 400 K
P2 = P1 (isobarik)
Ditanyakan:
a. V2 = ... ?
b. W = ... ?
Jawab :
a. V1/V2
= T1/T2
V2 = V1T2/T1
= (400 × 1,2×10-2)/300 = 1,6 × 10-2 m3
Jadi, volume gas akhir
sebesar 1,6 × 10-2 m3
b. W = P × Δ V = P × (V2
– V1)
= 1,5 × 105
(1,6 × 10-2 – 1,2 × 10-2)
= (1,5 × 105)
× (0,4 × 10-2)
= 0,6 × 103
= 6 × 104 J
Jadi usaha luar yang
dilakukan oleh gas sebesar W = 6 × 104 J
Energi
dalam gas monoatomik
Coba Anda ingat lagi
pada pembahasan sebelumnya tentang teori kinetik gas. Berapa energi kinetik
total yang dimiliki oleh sistem yang terdiri atas N buah partikel gas? Besarnya
energi total ini disebut sebagai “energi dalam” sistem, yaitu U = N · Ek.
Karena N×Ek = 3/2 PV,
maka U = 3/2 PV dan dengan melihat lagi persamaan gas ideal pV = nRT, maka akan
diperoleh persamaan sebagai berikut.
U
= 3/2 nRT
Berdasarkan persamaan
tersebut dapat disimpulkan bahwa suatu sistem gas akan mengalami perubahan
energi dalamnya jika mengalami perubahan suhu.
Contoh
soal
Suatu gas yang berada
dalam ruang yang fleksibel memiliki tekanan 1,5 × 105 Pa, suhu 27º
C, dan volume 12 liter. Ketika gas menyerap kalor suhunya menjadi 127º C. Hitunglah
energi gas mula-mula, volume gas sekarang, energi dalam sistem gas sekarang!
Diketahui : P1=
1,5 × 105 Pa
T1 = 27 +
273 = 300 K
V1 = 12
liter = 1,2 × 10-2 m3
T2 = 127 +
273= 400 K
Ditanyakan:
a. U1 = ...?
b. V2 = ...?
c. U2 = ...?
Jawab :
a. U1 = n R
T1 = 3/2 P1V1
= 3/2 (1,5 × 105)
× (1,2 · 10-2)
= 2,7 × 103
J
b. V1/V2
= T1/T2
V2 = V1T2/T1
= (400 × 1,2×10-2)/300 = 1,6 × 10-2 m3
c. U2 = n R
T2 = 3/2 P2V2
= 3/2 × (1,5 × 105)
× (1,6 × 102)
= 3,6 × 103
J
Usaha luar dan energi dalam, Pengertian dan Persamaan Usaha Luar dan Energi Dalam, Pengertian Usaha Luar dan Energi Dalam, Persamaan Usaha Luar dan Energi Dalam, Rumus Usaha Luar dan Energi Dalam, rumus dan pengertian usaha luar, rumus dan pengertian energi dalam, termodinamika, Energi dalam gas monoatomik, pengertian Energi dalam gas monoatomik, persamaan, Energi dalam gas monoatomik, rumus Energi dalam gas monoatomik, Fisika SMA, materi fisika SMA, materi fisika SMA kelas X, materi fisika SMA kelas XI, materi fisika SMA kelas XII, fisika SMP, soal dan latihan fisika, persiapan UN fisika, rumus dan persamaan-persamaan fisika









0 komentar:
Post a Comment